|
31 Okt |
Strahlentherapie mobilisiert das Immunsystem gegen Tumoren Blut, Immunsystem, Krebs, Tumore 31. Oktober 2013 Blut, Immunsystem, Krebs, Tumore 31. Oktober 2013
|
Das körpereigene Immunsystem kann eine effektive Waffe gegen Krebs sein. Doch ein Tumor verändert seine Umgebung häufig so, dass die Abwehrzellen ihn von der Blutbahn aus nicht mehr erreichen können. Wissenschaftler des Deutschen Krebsforschungszentrums (DKFZ) haben nun herausgefunden, dass eine lokale und niedrig dosierte Bestrahlung die Blutgefäße für Abwehrzellen durchlässig machen kann. Die Fachzeitschrift Cancer Cell hat diese Ergebnisse jetzt veröffentlicht.
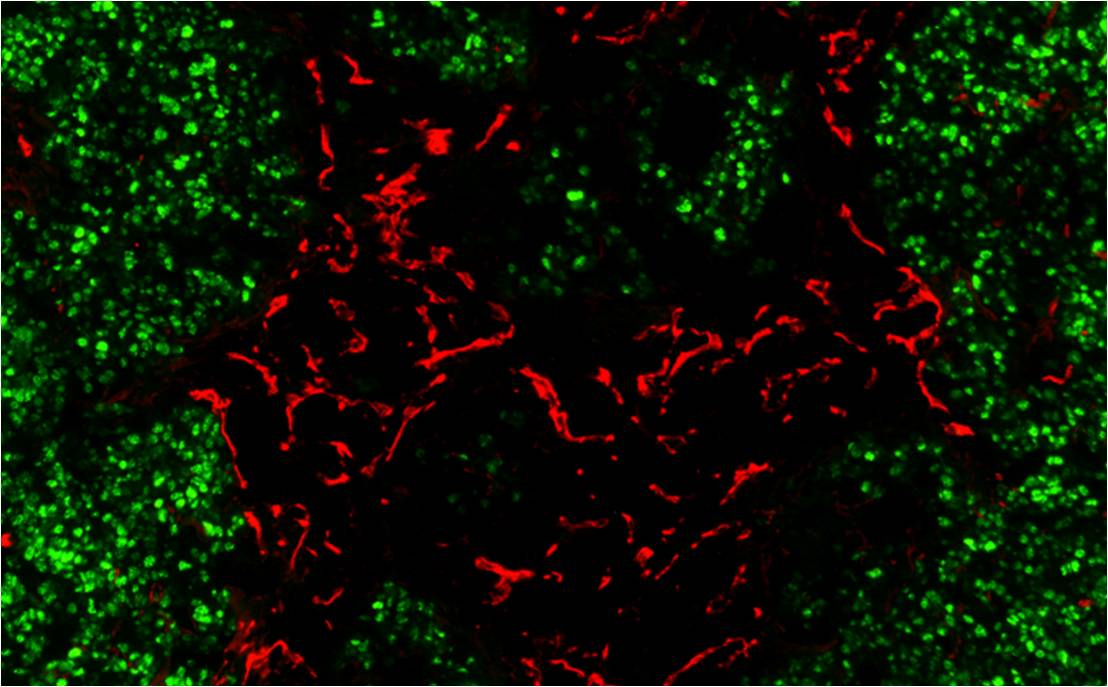
Immuntherapie Glutgefässe
Rot: ein großes Problem für die Immuntherapie bei Krebs: Fehlerhaft ausgebildete Blutgefäße. Grün: Tumorzellen
Foto@DKFZ
Das Immunsystem hat die Aufgabe, Fremdkörper zu erkennen und zu zerstören. Damit schützt es den Körper vor Krankheitserregern ─ und vor Krebs. Denn Krebszellen entstehen zwar aus Körperzellen. Doch ihr Erbgut und damit ihre Eiweißausstattung ist oft so stark verändert, dass bestimmte Immunzellen sie als fremd erkennen. Ist das der Fall, wandern sogenannte T-Killerzellen in das Tumorgewebe ein und töten die Krebszellen ab. Reagiert das Immunsystem nicht, kann man ihm auf die Sprünge helfen: Schon vor einigen Jahren war es Forschern gelungen, T-Killerzellen im Reagenzglas auf den Tumor „abzurichten“. Injiziert man diese aktivierten T-Killerzellen dem Patienten, bleibt der Effekt jedoch oft aus – denn viele erreichen den Tumor gar nicht.
Der Körper bildet für gewöhnlich an der Stelle im Blutgefäß, wo Abwehrzellen in das Gewebe auswandern und Fremdkörper bekämpfen sollen, bestimmte Ankermoleküle. An diesen können sich die Abwehrzellen im Vorbeischwimmen festhalten und so die Blutbahn verlassen. Tumoren verhindern jedoch oft, dass diese Ankermoleküle entstehen und die T-Killerzellen einwandern können. Hier setzten die Heidelberger Wissenschaftler um Professor Philipp Beckhove an. Die Idee: Niedrig dosierte, lokale Strahlen sollen im Tumorgewebe eine Abwehrreaktion provozieren, die bewirkt, dass Ankermoleküle an den Gefäßwänden entstehen. „Bei Mäusen mit Bauchspeicheldrüsenkrebs hatte diese Strategie bereits Erfolg“, so Philipp Beckhove. „In den bestrahlten Tumoren bildeten sich wieder Ankermoleküle. Außerdem sammelten sich dort viermal mehr T-Killerzellen an als in den unbestrahlten Tumoren.“ Verabreichten die Forscher den Tieren zusätzlich zur Strahlentherapie aktivierte T-Killerzellen, so wanderten auch sie in den Tumor ein. Und nicht nur das: „Diese Mäuse lebten mindestens zehn Wochen länger als Mäuse, die entweder nur eine Bestrahlung oder nur aktivierte T-Zellen bekommen hatten.“
Phillip Beckhove und sein Team vermuteten, dass Makrophagen, ein weiterer Typ von Abwehrzellen, an dieser durch Strahlen provozierten Abwehrreaktion beteiligt sind. „Zwar war schon seit Längerem bekannt, dass sich Makrophagen im Tumorgewebe ansammeln“, erklärt Phillip Beckhove. „Bislang dachte man jedoch, dass sie mehr schaden als nutzen.“ Um die Rolle der Makrophagen zu klären, bestrahlten die Forscher in einem weiteren Versuch nicht den Tumor, sondern nur Makrophagen aus gesunden Mäusen. Diese verabreichten sie dann den krebskranken Mäusen zusammen mit den aktivierten T-Killerzellen. Das Ergebnis: Wie zuvor wanderten die T-Killerzellen ins Tumorgewebe und bekämpften den Tumor. Damit wiesen die Forscher nach, dass tatsächlich die Makrophagen auf die Bestrahlung reagieren und eine Abwehrreaktion auslösen. „Erstaunlicherweise ist dafür nur ein einziges Gen namens iNOS verantwortlich. Es wird in den Makrophagen aktiviert, wenn sie Strahlung ausgesetzt sind.“
Auch im menschlichen Körper lockt die Bestrahlung des Tumors T-Killerzellen an. Das haben erste klinische Studien bei Patienten mit Bauchspeicheldrüsen- oder Darmkrebs ergeben. Dafür hatten die Wissenschaftler die Patienten vor der geplanten Operation mit einer 10 bis 30-fach niedrigeren Strahlendosis als üblich behandelt und anschließend den entfernten Tumor untersucht. „Nun hoffen wir, dass diese niedrig dosierte Bestrahlung auch den Krankheitsverlauf beim Menschen positiv beeinflussen kann“, so Beckhove. „Denn dann könnte man sie möglicherweise bei der Therapie von inoperablen Tumoren einsetzen, etwa um die Wirksamkeit einer anschließenden Immuntherapie zu verbessern.“
Felix Klug, Hridayesh Prakash, Peter E. Huber, Tobias Seibel, Noemi Bender, Niels Halama, Christina Pfirschke, Ralf Holger Voss, Carmen Timke, Ludmila Umansky, Kay Klapproth, Knut Schäkel, Natalio Garbi, Dirk Jäger, Jürgen Weitz, Hubertus Schmitz-Winnenthal, Günter J. Hämmerling und Philipp Beckhove: Low-Dose Irradiation Programs Macrophage Differentiation to an iNOS+/M1 Phenotype that Orchestrates Effective T Cell Immunotherapy, Cancer Cell, DOI: 10.1016/j.ccr.2013.09.014.
Weitere Infromationen unter: www.dkfz.de